Le coin des amatheurs de sciences version 2 
Les sections du site : Le site  FORUM
FORUM  L'espace
L'espace  La génétique
La génétique  Médecine
Médecine  Physique
Physique  Tintin et la science
Tintin et la science  Ecologie - nucléaire
Ecologie - nucléaire  Mystères de l'histoire
Mystères de l'histoire  Humour
Humour  Divers
Divers
Le coin des amatheurs de sciences version 2 
Les sections du site : Le site  FORUM
FORUM  L'espace
L'espace  La génétique
La génétique  Médecine
Médecine  Physique
Physique  Tintin et la science
Tintin et la science  Ecologie - nucléaire
Ecologie - nucléaire  Mystères de l'histoire
Mystères de l'histoire  Humour
Humour  Divers
Divers
| Physique |
|---|
| Le rayon vert |
| Apesanteur dans l'ascenseur |
| La classification périodique |
| La physique des spaghettis |
| Albert Einstein |
| Premier pas vers l'invisibilité |
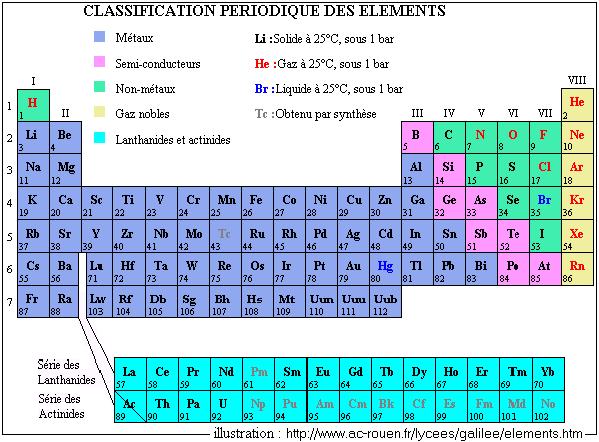
La classification périodique des éléments a été réalisée en 1869 par Mendeleïev. On connaissait alors 69 éléments, et Mendeleïev avait laissé dans son tableau des cases vides correspondant à des éléments qui selon lui seraient un jour découverts, ce qui s'est en effet réalisé.
Le premier problème rencontré par Mendeleïev est le fait que l'existence des isotopes rend la classification par masse atomique difficile. Cependant, il utilisa ce classement, qui fut conservé jusqu'en 1913. C'est grâce au physicien Moseley (recherches sur les spectres des rayons X) qu'on a adopté le classement par nombre atomique (Z) : celui-ci augmente avec les périodes (ou lignes) et diminue avec les colonnes, lignes et colonnes étant inversées dans la table d'origine. Le tableau actuel, imposé par l'Union Internationale de Chimie Pure et Appliquée (UICPA), et universellement utilisé, comporte 18 colonnes (correspondant à des groupes d'éléments), soit au total une centaine d'éléments. Il arrive cependant qu'on découvre de nouveaux éléments (des éléments artificiels, conçus en laboratoire). La liste des éléments est tenue à jour par l'UICPA et peut être consultée sur son site : http://www.iupac.org.
Les deux groupes les plus connus sont les groupes trois à six des colonnes 2 et 3 (les éléments essentiels à la vie comme le carbone C, l'azote N, l'oxygène O, etc, les constituants de la croûte terrestre et de l'atmosphère et les alcalins comme le sodium Na) ainsi que le groupe 18 (gaz nobles ou rares : hélium He, argon Ar, néon Ne,...).
Les noms des éléments sont souvent dus à leurs propriétés ou à leur découverte : l'hydrogène permet la synthèse de l'eau, le phosphore apporte la lumière, le francium (Fr, Z = 87) a été découvert en France. Les éléments de Z = 101 à Z = 103, sont appelés respectivement Fermium, Mendélévium et Nobélium.
A partir de 104, chaque élément est nommé en ajouter le suffixe -ium à une racine latine indiquant les trois chiffres de Z : unnilquadium pour 104, ununquadium pour 114, binilnilium pour 200, unnilpentium pour 105,...
De nombreux éléments possèdent plusieurs isotopes. Deux isotopes sont deux atomes dont les noyaux possèdent le même nombre de protons (Z), mais pas le même nombre de neutrons. Les isotopes sont nommés par le nom de l'élément principal correspondant à la valeur de Z, suivi du nombre de nucléons (nucléon est un nom général pour proton et neutron) On a par exemple le carbone 12 (6 protons + 6 neutrons) et le carbone 14 (6 protons + 8 neutrons). L'existence des isotopes permet aux scientifiques de calculer l'âge des êtres vivants (voir encadré 1).
Certains noyaux peuvent se désintégrer (naturellement ou par un apport d'énergie par l'humain) : c'est la radioactivité. Le noyau de fer est le plus stable de tous, il ne donne lieu à aucune réaction nucléaire. Les noyaux trop lourds, c'est-à-dire dont Z dépasse la valeur de Z pour le fer, sont instables et ont tendance à se désintégrer pour engendrer plusieurs noyaux plus légers. On parle alors de fission nucléaire : l'Uranium 238 donne le plomb 206. Les noyaux trop légers ont eux tendance à réagir entre eux pour donner des noyaux plus lourds. On parle dans ce cas de fusion nucléaire : le carbone 14 donne l'azote 14. Ces réactions sont à la base de la technologie nucléaire, qu'elle soit civile (centrales), militaire (bombes A ou H, voir La bombe H et le Nobel) ou même médicale (IRM), mais permettent aussi de réaliser des datations (voir encadré 2).